科学家使用新的电方法来观察阿尔茨海默氏症的临界点
科学家们还不清楚tau蛋白是如何从我们大脑正常功能所必需的良性蛋白质转变为有毒的神经原纤维缠结的,这是阿尔茨海默氏症和其他神经退行性疾病的特征。
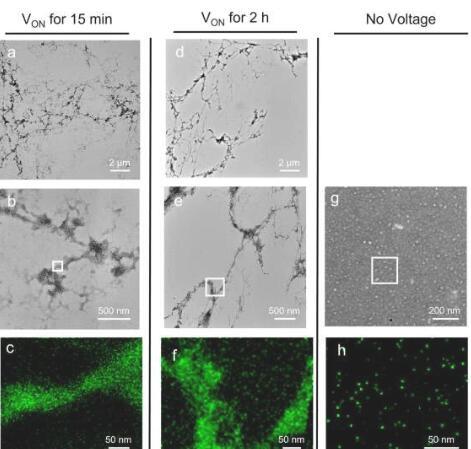
但是,加州大学圣巴巴拉分校的研究人员开发的一种新方法能够实时控制和跟踪它发生的过程。该技术采用低压电的新用途作为触发蛋白质折叠和组装的自然信号的替代物,无论是在大脑中的正常功能还是导致通常致命疾病的失控过程。
“这种方法为科学家提供了一种新的方法来触发并同时观察蛋白质从好到坏的动态变化,”生物化学和分子遗传学杰出名誉教授Daniel E. Morse说,他是发表在《生物化学杂志》上的一篇论文的资深作者。
“该方法应该广泛用于识别在许多不同但相关的淀粉样蛋白疾病中指导不同组装轨迹的分子和条件,”Eloise Masqulier说,他是来自分子生物学,化学和工程的学生,研究人员和教师的跨学科团队的主要作者,包括Esther Taxon,Sheng-Ping Liang,Yahya Al Sabeh,Lior Sepunaru和Michael J. Gordon。
在正常情况下,tau是一种可溶性蛋白质,开始时呈开放,松散的构型,就像一根绳子。响应信号,tau蛋白折叠起来并逐渐相互组装,使它们能够与微小的圆柱形结构(微管)结合,这些结构支持神经元的形状并在细胞内运输营养物质和分子。然而,在病理情况下,信号走得太远,导致蛋白质不受控制地组装,形成不溶性淀粉样蛋白丝,在神经元内变成神经原纤维缠结,中断它们的功能并最终杀死它们。
使用他们的新方法与tau的核心部分(肽),研究人员能够观察和分析正常,可逆折叠和组装与不可逆的病理组装之间的关键“临界点”,这是taupathic,神经退行性疾病的基础。科学家们使用不到一伏的电势来模拟过度磷酸化(促进疾病的信号),在他们的实验室实验中触发并微调了tau肽的折叠,使用光谱方法揭示折叠的细节和渐进组装形成淀粉样细丝。
与其他检查蛋白质折叠和组装的模式不同,例如X射线衍射或冷冻电子显微镜,它们提供了及时发生的过程的静态快照,新的电化学方法允许用户连续见证和分析渐进式,动态折叠和组装的细节实时发生,允许首次直接观察这些过程中关键的早期步骤。此外,与以前用于tau及其核心肽研究的大多数技术不同,由于电触发与自然触发信号非常相似,因此该方法允许直接观察这些过程,而无需额外的“辅助”分子。
作者报告说,该技术还可以用作更快速地测试和识别可能对预防或治疗阿尔茨海默氏症和其他淀粉样蛋白疾病有用的药物和抗体的工具。
“因为我们可以随意打开和微调这个过程,”莫尔斯解释说,“我们可以使用这个系统来观察哪些分子可以拦截或阻止折叠和组装的特定阶段。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
安徽淮南地区的长安汽车经销商近期对2025款启源Q05车型的市场策略进行了调整,以进一步吸引消费者。作为长安汽...浏览全文>>
-
近年来,豪华SUV市场持续升温,而作为大众旗下的高端品牌,途锐凭借其卓越的性能与豪华配置,一直深受消费者的...浏览全文>>
-
在新能源汽车市场中,一汽-大众ID 4 CROZZ凭借其出色的性价比和丰富的配置吸引了众多消费者的关注。作为一款...浏览全文>>
-
近年来,随着国内汽车市场的快速发展,越来越多的消费者开始关注性价比高的小型车。QQ多米作为一款备受关注的...浏览全文>>
-
在当今的汽车市场中,选择一款高性价比的车型是许多消费者的重要考量。对于追求品质与经济平衡的购车者来说,...浏览全文>>
-
阜阳地区消费者对上汽大众途岳的关注度一直很高,尤其是2025款途岳的上市更是引发了广泛关注。作为一款紧凑型S...浏览全文>>
-
天津滨海长安猎手K50作为一款备受关注的车型,在市场上拥有较高的关注度。这款车型以其出色的性能和合理的价格...浏览全文>>
-
近年来,随着新能源汽车的普及,插电混动车型因其兼顾燃油经济性和驾驶性能的特点,受到了越来越多消费者的青...浏览全文>>
-
途观X作为上汽大众旗下的高端轿跑SUV车型,凭借其时尚动感的外观设计和丰富的科技配置,在市场上一直备受关注...浏览全文>>
-
在选择SUV车型时,上汽大众途昂凭借其宽敞的空间和强大的性能成为不少消费者的首选。对于蚌埠地区的消费者来说...浏览全文>>
- 天津滨海长安猎手K50多少钱 2025款落地价,最低售价18.29万起,赶紧行动
- 天津滨海ID.4 CROZZ 2025新款价格,买车省钱秘籍
- 安徽淮南途昂X多少钱?性价比超高的选车秘籍
- 福特领睿试驾,开启完美驾驭之旅
- 比亚迪海豹05DM-i试驾预约流程
- 凯迪拉克CT5预约试驾,从预约到试驾的完美旅程
- 滁州途观X落地价,各配置车型售价全知晓
- 极狐 阿尔法T6试驾,开启完美驾驭之旅
- 长安欧尚520试驾操作指南
- QQ多米试驾需要注意什么
- 长安Lumin试驾,感受豪华与科技的完美融合
- 安庆长安猎手K50最新价格2025款与配置的完美平衡
- 池州迈腾GTE最新价格2022款全解,买车必看的省钱秘籍
- 安徽亳州ID.6 X多少钱?购车全攻略来袭
- 五菱雪宝试驾,开启豪华驾驶之旅
- 马自达EZ-6预约试驾,新手必看的详细流程
- 安徽亳州T-ROC探歌落地价实惠,配置丰富,不容错过
- 滁州高尔夫GTI价格大揭秘,买车前必看
- 东莞威然落地价,最低售价22.99万起优惠不等人
- 试驾王牌M7,体验豪华驾乘的乐趣
