新研究表明铜与溶菌酶偶联具有优异的活性氧去除能力
在需氧生物中,活性氧(ROS),如氢氧化物(OH)、单线态氧(1O2)、过氧化氢(H2O2)和超氧化物(O2–)离子在有氧呼吸过程中产生,对体内生物分子造成严重的氧化损伤。因此,去除 ROS,特别是2–,是最重要的,因为它与 H 反应产生其他有毒的 ROS 物种,如 H+2O2和哦。
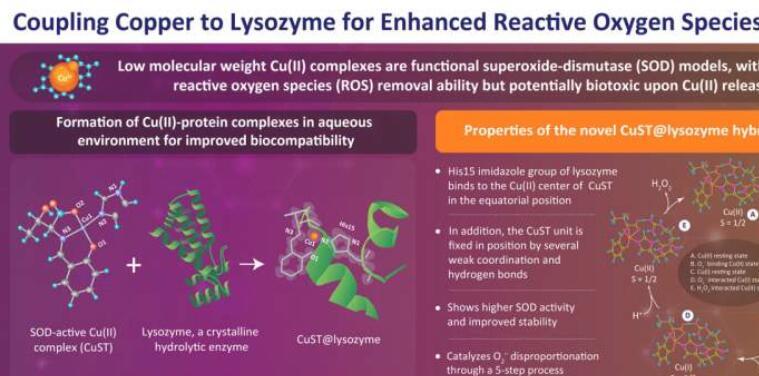
这是通过称为超氧化物歧化酶(SOD)的金属酶实现的。这些酶在其活性中心具有金属离子(如Ni,Fe,Mn,Cu和Zn),催化O的分解2–到 H2O2和 O2.在这方面,低分子量Cu(II)配合物作为具有高SOD活性的功能性SOD模型变得越来越重要。然而,它们受到Cu(II)释放后对生物分子有毒的趋势的限制。
在最近的一项研究中,由东京理科大学(TUS)化学系的助理教授Daisuke Nakane和Takashiro Akitsu教授领导的一组研究人员开发了一种具有增强ROS活性的新型金属 - 蛋白质杂交复合物。他们将水解酶溶菌酶与SOD活性Cu(II)复合物偶联形成杂交溶菌酶CuST@lysozyme,表现出良好的SOD活性,但生物毒性低。
“我们研究了由溶菌酶和功能性SOD模拟Cu(II)复合物组成的杂交蛋白的形成。我们选择溶菌酶是因为它的稳定性和结晶度。我们推测,由此产生的SOD模拟杂交蛋白将提高功能性SOD模型Cu(II)复合物的生物相容性和稳定性,“Nakane博士解释说,这是他们研究背后的基本原理。该研究发表在《科学报告》上。
通过详细的晶体学和光谱分析,由TUS的Kenichi Kitanishi助理教授,南方联邦大学的Arshak Tsaturyan博士和茨城大学的Masaki Unno教授组成的研究小组证实了杂交蛋白CuST@lysozyme的形成,并阐明了其结构。
他们报告说,溶菌酶的His15咪唑基团在赤道位置与CuST的Cu(II)中心结合,而CuST单元通过几个弱配位和氢键轴向固定。此外,他们还建议 O2–可以协调到Cu(II)中心。通过测定,研究人员建立了生物相容性CuST@lysozyme杂交蛋白复合物的高SOD活性和稳定性。
基于他们的光谱和量子计算,该团队提出了O的五步机制。2–复合体的不成比例。这些步骤是(1)Cu(II)静息状态,(2)O2–-结合Cu(II)态,(3)羧酸配体质子化后的Cu(I)静息态,(4)O2–-相互作用的Cu(I)状态和(5)H2O2-相互作用的Cu(II)状态。
他们进一步表明,通过使用晚期过渡金属复合物结合溶菌酶来抑制配体解离,通过使用具有氢键部分的配体来增加复合物与溶菌酶之间的相互作用,以及引入酸性官能团来对抗溶菌酶的基本侧链,可以提高复合物的稳定性。
该研究引入了一类新的SOD活性杂交蛋白复合物,这些复合物具有生物相容性,并且在模拟复合物分解后与体液没有副反应。“我们已经战略性地提高了金属溶菌酶复合材料的稳定性,特别是在血浆和细胞质等生物体液中的稳定性。这应该为更深入地讨论他们的治疗应用铺平道路,“Akitsu教授总结道。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
安徽淮南地区的长安汽车经销商近期对2025款启源Q05车型的市场策略进行了调整,以进一步吸引消费者。作为长安汽...浏览全文>>
-
近年来,豪华SUV市场持续升温,而作为大众旗下的高端品牌,途锐凭借其卓越的性能与豪华配置,一直深受消费者的...浏览全文>>
-
在新能源汽车市场中,一汽-大众ID 4 CROZZ凭借其出色的性价比和丰富的配置吸引了众多消费者的关注。作为一款...浏览全文>>
-
近年来,随着国内汽车市场的快速发展,越来越多的消费者开始关注性价比高的小型车。QQ多米作为一款备受关注的...浏览全文>>
-
在当今的汽车市场中,选择一款高性价比的车型是许多消费者的重要考量。对于追求品质与经济平衡的购车者来说,...浏览全文>>
-
阜阳地区消费者对上汽大众途岳的关注度一直很高,尤其是2025款途岳的上市更是引发了广泛关注。作为一款紧凑型S...浏览全文>>
-
天津滨海长安猎手K50作为一款备受关注的车型,在市场上拥有较高的关注度。这款车型以其出色的性能和合理的价格...浏览全文>>
-
近年来,随着新能源汽车的普及,插电混动车型因其兼顾燃油经济性和驾驶性能的特点,受到了越来越多消费者的青...浏览全文>>
-
途观X作为上汽大众旗下的高端轿跑SUV车型,凭借其时尚动感的外观设计和丰富的科技配置,在市场上一直备受关注...浏览全文>>
-
在选择SUV车型时,上汽大众途昂凭借其宽敞的空间和强大的性能成为不少消费者的首选。对于蚌埠地区的消费者来说...浏览全文>>
- 天津滨海长安猎手K50多少钱 2025款落地价,最低售价18.29万起,赶紧行动
- 天津滨海ID.4 CROZZ 2025新款价格,买车省钱秘籍
- 安徽淮南途昂X多少钱?性价比超高的选车秘籍
- 福特领睿试驾,开启完美驾驭之旅
- 比亚迪海豹05DM-i试驾预约流程
- 凯迪拉克CT5预约试驾,从预约到试驾的完美旅程
- 滁州途观X落地价,各配置车型售价全知晓
- 极狐 阿尔法T6试驾,开启完美驾驭之旅
- 长安欧尚520试驾操作指南
- QQ多米试驾需要注意什么
- 长安Lumin试驾,感受豪华与科技的完美融合
- 安庆长安猎手K50最新价格2025款与配置的完美平衡
- 池州迈腾GTE最新价格2022款全解,买车必看的省钱秘籍
- 安徽亳州ID.6 X多少钱?购车全攻略来袭
- 五菱雪宝试驾,开启豪华驾驶之旅
- 马自达EZ-6预约试驾,新手必看的详细流程
- 安徽亳州T-ROC探歌落地价实惠,配置丰富,不容错过
- 滁州高尔夫GTI价格大揭秘,买车前必看
- 东莞威然落地价,最低售价22.99万起优惠不等人
- 试驾王牌M7,体验豪华驾乘的乐趣
